چگونگی جذب و انتقال آب در گیاهان آوندی
توسط: اندرو جی. مک الرون (دپارتمان کشاورزی ایالات متحده، تحقیقات کشاورزی، دانشگاه کالیفرنیا، دیویس)
برندن چوت (دانشگاه وسترن سیدنی)
گرگ آ. گامبتا (دانشگاه کالیفرنیا، دیویس)
و کریگ آر. برودرسن (دانشگاه) از فلوریدا)
برگردان
محمد فتاحی
خردادماه 1403
سئوالات قابل طرح
1 – چگونه آب ازریشه ها به درون تنه یا ساقه گیاهان حرکت و به بالای درختان بلند یا گیاهان میرسد؟
2 -آیا گیاهان همه آب جذب شده را مصرف می کنند ؟
3 – اگر آب برای رشد و بقای گیاه بسیار مهم است؟ پس چرا گیاهان بخشی از میزان آب را به هدر می دهند؟
4 – تعرق چیست؟ چرا فتوسنتز شکل میگیرد؟چرا روزنه ها در برگها باز و بسته می شوند؟چرا ریشه گیاهان یا درختان حالت انحنا دارند؟
5 – چه عواملی باعث کاهش یا انسداد انتقا ل آب در اوندهای چوبی میگردند؟
6- ایا شکستگی یا زخم روی تنه ها یا سایر عوامل بیماریزا باعث توقف جریان اب در گیاهان می شوند؟

چرا گیاهان به آب زیادی نیاز دارند؟
آب محدودترین عامل غیرزیست (غیر زنده) برای رشد و بهره وری گیاهان وعامل تعیین کننده اصلی توزیع پوشش گیاهی در سراسر جهان است.
از قدیم الایام، بشر تشنگی گیاهان را تشخیص داده است، همانطور که وجود سیستم های آبیاری در ابتدای تاریخ ثبت شده، نشان می دهند. اهمیت آب برای گیاهان از نقش اصلی آن در رشد و فتوسنتز و توزیع مولکول های آلی و معدنی ناشی می شود. با وجود این وابستگی، گیاهان کمتر از 5 درصد آب جذب شده توسط ریشه را برای گسترش سلولی و رشد گیاه حفظ می کنند. باقیمانده از طریق گیاهان مستقیماً وارد جو می شوند، فرآیندی که به آن تعرق می گویند. مقدار آب از دست رفته از طریق تعرق می تواند فوق العاده زیاد باشد. یک گیاه ذرت آبی که در کانزاس ( آمریکا ) رشد می کند می تواند در طول تابستان معمولی 200 لیتر آب مصرف کند، در حالی که برخی از درختان جنگل های بارانی بزرگ می توانند تقریباً 1200 لیتر آب در یک روز مصرف کنند.
اگر آب برای رشد و بقای گیاه بسیار مهم است، پس چرا گیاهان این همه مقدار از آن را هدر می دهند؟ پاسخ به این سوال در فرآیند دیگری به نام فتوسنتز نهفته است که برای گیاهان حیاتی است .
فتوسنتز برای تولید قند در گیاهان شکل میگیرد، گیاهان باید دی اکسید کربن (CO2) را از جو از طریق منافذ کوچک در برگ های خود به نام روزنه جذب کنند (شکل 1). با این حال، هنگامی که روزنهها باز میشوند، آب با سرعت زیادی نسبت به مقدار کمی CO2 جذب شده در جو از بین میروند.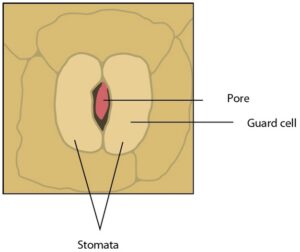
در میان گونه های گیاهی به ازای هر مولکول CO2 به دست آمده، به طور متوسط 400 مولکول آب از بین می روند. تعادل بین تعرق و فتوسنتز یک سازش اساسی در وجود گیاهان است. روزنه ها برای ساختن قندها باید باز باقی بمانند اما در این فرآیند خطر کم آبی بدن آنها را تهدید می کنند.
شکل 1: نمایش روزنه باز روی سطح برگ تنباکو.
روزنه ها منافذی هستند که در سطح برگ یافت می شوند و تبادل گازها را بین فضای داخلی برگ و جو تنظیم می کنند. بسته شدن روزنه یک پاسخ طبیعی به تاریکی یا خشکسالی به عنوان وسیله ای برای حفظ آب است. منافذ ( pore) ، دیواره سلول ( Guard cell)،روزنه ( Stomata)
جذب آب از خاک به گیاه
اساساً تمام آب مورد استفاده گیاهان زمینی توسط ریشه از خاک جذب می شوند. سیستم ریشه شامل شبکه پیچیده ای از ریشه های منفرد است که از نظر سن با هم متفاوت هستند. ریشه ها از نوک خود رشد می کنند و در ابتدا ریشه های ظریف و نازک و غیر چوبی تولید می کنند. ریشه های ریز نفوذ پذیرترین بخش سیستم ریشه هستند و تصور می شود که بیشترین توانایی جذب آب را دارند، به ویژه در گیاهان علفی (یعنی غیر چوبی) (McCully 1999). ریشه های ظریف توسط موهای ریشه پوشانده شده اند و به طور قابل توجهی سطح جذب آب را افزایش می دهند و تماس بین ریشه و خاک را بهبود می بخشد (شکل 2).
برخی از گیاهان نیز با ایجاد روابط همزیستی با قارچهای میکوریز، جذب آب را بهبود میبخشند، که به طورعملکردی سطح کل جذبی سیستم ریشه را افزایش میدهند.
شکل 2: موهای ریشه اغلب روی ریشه های ریز تشکیل می شوند و با افزایش سطح ریشه و با بهبود تماس با خاک، جذب آب را بهبود می بخشند.
ریشههای گیاهان چوبی با افزایش سن، مانند تنه درختان بزرگ، پوست ایجاد میکنند. در حالی که تشکیل پوسته نفوذپذیری ریشه های مسن را کاهش می دهند، آنها همچنان می توانند مقادیر قابل توجهی آب را جذب کنند (MacFall et al. 1990, Chung & Kramer 1975). این برای درختان و درختچه ها مهم است زیرا ریشه های چوبی می توانند 99٪ از سطح ریشه را در برخی از جنگل ها تشکیل دهند (Kramer & Bullock 1966).
هیدروتروپیسم چیست ؟
ریشه ها توانایی شگفت انگیزی دارندکه دور ازمکان های خشک به سمت لکه های مرطوب تر در خاک رشد می کنند این پدیده را هیدروتروپیسم گویند.
هیدروتروپیسم مثبت زمانی اتفاق میافتد که از کشیدگی سلول در سمت مرطوب ریشه جلوگیری شود، در حالی که کشیدگی در سمت خشک تحت تأثیر قرار نگرفته یا کمی تحریک میشود و منجر به انحنای ریشه و رشد به سمت یک لکه مرطوب میشوند (Takahashi 1994). کلاهک ریشه به احتمال زیاد محل هیدروسنسینگ است. در حالی که مکانیسم دقیق هیدروتروپیسم شناخته نشده است، کاراخیر با مدل گیاهی آرابیدوپسیس،کمی مکانیسم را در سطح مولکولی روشن کرده است (برای جزئیات بیشتر به Eapen و همکاران 2005 مراجعه کنید).ریشههای بسیاری از گونههای چوبی توانایی رشد گستردهای برای کشف حجم زیادی از خاک را دارند.
ریشه های عمیق (بیش از 5 متر) در بیشتر محیط ها یافت می شوند (Canadell et al. 1996, Schenk & Jackson 2002) وبه به گیاهان اجازه می دهند از منابع آب دائمی در عمق قابل توجهی به آب دسترسی داشته باشند (شکل 3). ریشههای درخت شپرد (Boscia albitrunca) در اعماق 68 متری در مرکز کالاهاری رشد میکنند، در حالی که ریشههای سایر گونههای چوبی میتوانند به صورت جانبی تا 50 متر در یک طرف گیاه گسترش پیدا کنند (Schenk & Jackson 2002). با کمال تعجب، اکثر گیاهان خشک دارای سیستم های ریشه ای بسیار کم عمق هستند و عمیق ترین ریشه ها به طور مداوم در اقلیم هایی با بارش شدید فصلی (به عنوان مثال، آب و هوای مدیترانه ای و موسمی) رخ می دهند.

شکل 4: ریشه های درختان در اعماق قابل توجهی که از طریق غارها قابل دسترسی هستند
دانشمندان گیاهی بررسی می کنند: ریشه های عمیق Juniperus asheii که در عمق 7 متری در غاری در آستین، TX ایالات متحده رشد می کند (سمت چپ). یک شبکه ریشه ظریف گسترده متصل به یک ریشه شیری با قطر ~ 1 سانتی متر که به یک جریان زیرزمینی چند ساله در عمق 20 متری در غاری در مرکز TX، ایالات متحده دسترسی دارد. و ریشه های پیچ خورده در غاری واقع در جنوب غربی استرالیا در زیر جنگلی که توسط Eucalyptus diversicolor غالب است – ریشه های این سیستم غار معمولاً از عمق 20-60 متری یافت می شوند.
انتقال آب از طریق گیاه به اتمسفر
جریان آب در برخی از قسمت های گیاه بهتر از قسمت های دیگر است. به عنوان مثال،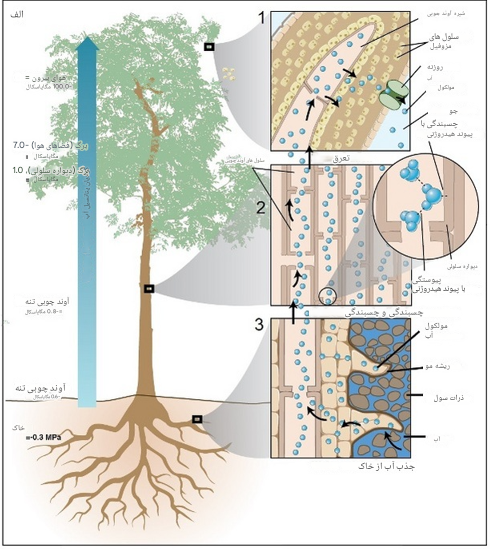
آب جذب شده توسط ریشه ها باید قبل از ورود به بافت انتقال آب تخصصی (که آوند چوبی نامیده می شود) از چندین لایه سلولی عبور کند (شکل 4). این لایه های سلولی به عنوان یک سیستم فیلتراسیون در ریشه عمل می کنند و مقاومت بسیار بیشتری در برابر جریان آب نسبت به آوند چوبی دارند، جایی که انتقال در لوله های باز انجام می شود. تفاوت بین فشار دادن آب از طریق فیلترهای قهوه ای متعدد در مقابل شلنگ باغچه را تصور کنید.
پس از جذب توسط ریشه، آب ابتدا از اپیدرم عبور می کند و سپس راه خود را به سمت مرکز ریشه طی می کند و قبل از رسیدن به آوند چوبی از قشر و اندودرم عبورمی کند (شکل 4) . اما نقش دقیق آنها در حمل و نقل آب فله هنوز حل نشده است.
شکل 4: نمایش مسیرهای انتقال آب در امتداد پیوستار خاک-گیاه-اتمسفر ((SPAC). شکل شماره 4
(الف) آب از مناطق با پتانسیل آب بالا (یعنی نزدیک به صفر در خاک) به پتانسیل کم آب (یعنی هوای خارج از برگها) حرکت می کند. جزئیات مکانیسم چسبندگی-تنش با پانل های داخلی (A) نشان داده شده است، که در آن کشش با تبخیر مولکول های آب در طول تعرق برگ (1) ایجاد می شوند و به پایین ستون های آب پیوسته و منسجم (2) از طریق آوند چوبی منتقل می شوند (3). مسیرهای حرکت آب به خارج از رگبرگها و از طریق روزنه (B) و در طول ریشههای ظریف (C) دقیق هستند و مسیرهای سمپلاستیک و آپوپلاستیک را نشان میدهند.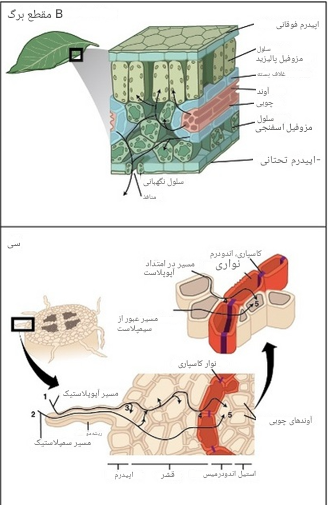
هنگامی که آب در بافت آوند چوبی قرار می گیرند، آب به راحتی در فواصل طولانی در این لوله های باز حرکت می کنند (شکل 5). دو نوع عنصر رسانا (یعنی لوله های انتقال) در آوند چوبی یافت می شوند: 1) تراکئیدها و 2) عروق (شکل 6). تراکئیدها از نظر قطر و طول کوچکتر از عروق هستند و در انتها مخروطی هستند. رگ ها از سلول های منفرد یا “عنصر کشتی” تشکیل شده اند که از انتها به انتها روی هم چیده شده اند تا لوله های باز پیوسته ای را تشکیل دهند که به آنها کانال آوند چوبی نیز می گویند. قطر رگ ها تقریباً به اندازه موی انسان است و طول آنها معمولاً حدود 5 سانتی متر است، اگرچه برخی از گونه های گیاهی دارای رگ هایی به طول 10 متر هستند. لولههای آوند چوبی بهعنوان مجموعهای از سلولهای زنده شروع میشوند، اما وقتی بالغ میشوند، سلولها دست به خودکشی میزنند (به آن مرگ سلولی برنامهریزی شده گفته میشود)، تحت یک ساختارشکنی منظم قرار میگیرند که در آن محتویات سلولی خود را از دست میدهند و لولههای توخالی تشکیل میدهند. همراه با لولههای رسانای آب، بافت آوند چوبی حاوی الیافی است که پشتیبانی ساختاری را فراهم میکنند و سلولهای پارانشیم فعال متابولیکی زنده که برای ذخیرهسازی کربوهیدراتها، حفظ جریان در یک مجرا مهم هستند (به جزئیات مربوط به ترمیم آمبولی در زیر مراجعه کنید)، و انتقال شعاعی آب و املاح. ادامه شکل شماره 4
شکل شماره 5: بازسازی سه بعدی آوند چوبی که در تاسیسات microCT گنت تصویربرداری شده است.
تفاوت در ساختار آوند چوبی و توزیع مجرا را می توان بین آوند چوبی Ulmus americana (چپ) و Fraxinus americana (راست) مشاهده کرد.
هنگامی که آب به انتهای یک مجرا می رسد یا از طرفی به مجرای مجاور عبور می کند،
باید از سوراخ های دیواره سلولی مجرا عبور کند (شکل 6). حفرههای مرزی حفرههایی
در دیوارههای سلولی ثانویه ضخیم عروق و تراکئیدها هستند که اجزای ضروری در سیستم حمل و نقل آب گیاهان عالی هستند. غشای گودال، متشکل از یک دیواره سلولی اولیه اصلاحشده و لایه میانی، در مرکز هر گودال قرار دارد و به آب اجازه میدهند از بین کانالهای آوند چوبی عبور کند و در عین حال گسترش
حبابهای هوا (یعنی آمبولی) و پاتوژنهای ساکن آوند چوبی را محدود میکند. بنابراین، غشاهای حفره ای به عنوان دریچه های ایمنی در سیستم انتقال آب گیاه عمل می کنند. به طور متوسط در طیف گسترده ای از گونه ها، چاله ها بیش از 50٪ از کل مقاومت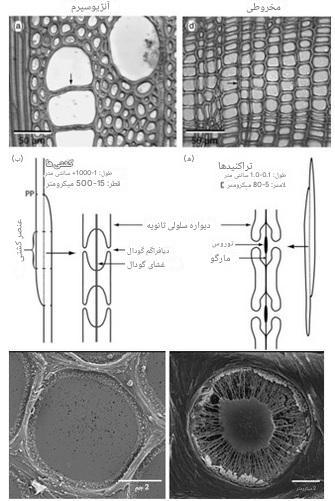
هیدرولیکی آوند چوبی را تشکیل می دهند. ساختار گودالها بهطور چشمگیری در بین گونهها متفاوت است، با تفاوتهای زیادی در میزان سطح دیوار مجرای پوشیده شده توسط چالهها، و در تخلخل و ضخامت غشاهای گودال (شکل 6).
شکل 6: مقایسه انواع چوب گیاهان گلدار وسوزنی برگان .
این ویژگی مجراهای وسیع تری از گیاهان گلدار (بالا)، بازسازی کارتونی عروق، تراکئیدها و غشای گودال آنها (وسط)، که در تصاویر SEM (پایین) نیز نشان داده شده است.
پس از حرکت آب از ریشه به ساقه از طریق آوند چوبی، آب از طریق آوند چوبی دمبرگ (یعنی ساقه برگ) وارد برگ ها می شود که از آن در ساقه منشعب می شود. آوند چوبی دمبرگ به دنده میانی (رگبرگ ضخیم اصلی برگها) منتهی می شود که سپس به رگبرگهای کوچکتر که حاوی تراکئیدها هستند (شکل 7) منشعب می شوند و در مزوفیل برگ جاسازی می شوند. در دو لپه ایها، رگه های کوچک اکثریت قریب به اتفاق طول کل رگ را تشکیل می دهند، و بخش عمده ای از آب تعرق شده از رگه های کوچک خارج می شود (Sack & Holbrook 2006, Sack & Tyree 2005). چینش رگبرگ، تراکم و افزونگی برای توزیع یکنواخت آب در برگ مهم هستند و ممکن است سیستم انتقال را در برابر آسیب (مانند ضایعات بیماری، گیاهخواری، انتشار حباب هوا) حفظ کنند. هنگامی که آب از آوند چوبی خارج می شود، در سراسر سلول های غلاف بسته ای که رگ ها را احاطه کرده اند حرکت می کند. هنوز مشخص نیست مسیر دقیق آب پس از عبور از آوند چوبی از طریق سلولهای غلاف بستهبندی و داخل سلولهای مزوفیل دنبال میشود، اما احتمالاً توسط مسیر آپوپلاستیک در طول تعرق غالب میشود (Sack & Holbrook 2005).
می دهند، و بخش عمده ای از آب تعرق شده از رگه های کوچک خارج می شود (Sack & Holbrook 2006, Sack & Tyree 2005). چینش رگبرگ، تراکم و افزونگی برای توزیع یکنواخت آب در برگ مهم هستند و ممکن است سیستم انتقال را در برابر آسیب (مانند ضایعات بیماری، گیاهخواری، انتشار حباب هوا) حفظ کنند. هنگامی که آب از آوند چوبی خارج می شود، در سراسر سلول های غلاف بسته ای که رگ ها را احاطه کرده اند حرکت می کند. هنوز مشخص نیست مسیر دقیق آب پس از عبور از آوند چوبی از طریق سلولهای غلاف بستهبندی و داخل سلولهای مزوفیل دنبال میشود، اما احتمالاً توسط مسیر آپوپلاستیک در طول تعرق غالب میشود (Sack & Holbrook 2005).
شکل 7: نمونه ای از یک الگوی تهویه برای نشان دادن مسیر هیدرولیکی از آوند چوبی دمبرگ به داخل سلول های برگ و بیرون از روزنه.
مکانیسم حرکت آب در گیاهان
بر خلاف حیوانات، گیاهان فاقد یک پمپ فعال متابولیکی مانند قلب برای حرکت مایع در سیستم عروقی خود هستند. در عوض، حرکت آب به طور غیر فعال توسط فشار و شیب پتانسیل شیمیایی هدایت می شوند. بخش عمده ای از آب جذب شده و منتقل شده از طریق گیاهان توسط فشار منفی ناشی از تبخیر آب از برگ ها (به عنوان مثال، تعرق) جابجا می شود .این فرآیند معمولاً به عنوان مکانیسم Cohesion-Tension (C-T) شناخته می شود. این سیستم قادر به عملکرد است زیرا آب منسجم است ، از طریق نیروهای ایجاد شده توسط پیوند هیدروژنی به خود می چسبد. این پیوندهای هیدروژنی به ستونهای آب در گیاه اجازه میدهند تا کشش قابل توجهی را حفظ کنند (تا 30 مگاپاسکال وقتی آب در مویرگهای کوچک موجود در گیاهان وجود دارد)، و به توضیح چگونگی انتقال آب به تاجپوشهای درخت در 100 متری سطح خاک کمک میکنند. بخش کششی مکانیسم C-T توسط تعرق ایجاد می شود. تبخیردر داخل برگها عمدتاً از سطوح دیواره سلولی مرطوب که توسط شبکه ای از فضاهای هوا احاطه شده است رخ می دهند. منیسک ها در این فصل مشترک هوا و آب تشکیل می شوند (شکل 4)، جایی که آب آپوپلاستیک موجود در مویرگ های دیواره سلولی در معرض هوای حفره زیر روزنه قرار می گیرند. با هدایت انرژی خورشید برای شکستن پیوندهای هیدروژنی بین مولکولها، آب از منیسکها تبخیر میشوند و کشش سطحی در این فصل مشترک، مولکولهای آب را برای جایگزینی مولکولهای از دست رفته در اثر تبخیر میکشد. این نیرو در امتداد ستون های آب پیوسته به ریشه ها منتقل می شوند و در آنجا باعث هجوم آب از خاک می شود. دانشمندان مسیر انتقال مداوم آب را پیوسته جوگیاهی خاک (SPAC) می نامند.
استفان هیلز اولین کسی بود که پیشنهاد کرد که جریان آب در گیاهان توسط مکانیسم C-T کنترل می شود. هیلز در کتاب خود در سال 1727 میگوید: چرا که آب باید بدون تعریق راکد شود، با وجود اینکه رگهای شیره به طرز عجیبی به دلیل ظرافت فوقالعادهشان سازگار شدهاند، تا آب را به ارتفاعات زیادی برسانند، به نسبت متقابلاً با قطر بسیار کوچکشان. اخیراً، یک سیستم جریان تبخیری مبتنی بر فشار منفی برای اولین بار توسط یک درخت مصنوعی در آزمایشگاه بازتولید شده است (Wheeler & Stroock 2008).
هنگامی که حرکت املاح نسبت به حرکت آب محدود می شود (یعنی در سراسر غشای سلولی نیمه تراوا)، آب بر اساس پتانسیل شیمیایی خود (یعنی وضعیت انرژی آب) توسط اسمز حرکت می کند – انتشار آب. اسمز نقش اصلی را در حرکت آب بین سلول ها و بخش های مختلف گیاهان دارد. در غیاب تعرق، نیروهای اسمزی بر حرکت آب به داخل ریشه غالب می شوند. این به صورت فشار ریشه و روده شدن ظاهر می شوند . فرآیندی که معمولاً در چمنزار ها دیده می شوند، جایی که قطرات آب در هنگام صبح پس از شرایط تبخیر کم در حاشیه برگ ها تشکیل می شوند. فشار ریشه زمانی حاصل می شود که املاح به غلظت بیشتری در آوند چوبی ریشه نسبت به سایر بافت های ریشه تجمع می یابند. گرادیان پتانسیل شیمیایی حاصل، هجوم آب را در سرتاسر ریشه و داخل آوند چوبی هدایت می کند. هیچ فشار ریشه در گیاهانی که به سرعت تعرق کنند، وجود ندارند، اما پیشنهاد شده است که در برخی از گونه ها فشار ریشه ها می تواند نقش اصلی را در پر کردن مجراهای آوند چوبی غیرعملکردی به ویژه پس از زمستان ایفا کنند. (روش جایگزین پر کردن مجدد را ببینید که در زیر توضیح داده شده است).
اختلال در حرکت آب
حمل و نقل آب می تواند در بسیاری از نقاط در امتداد پیوسته جو گیاهی خاک (SPAC) ناشی از عوامل زنده و غیر زنده مختل شود (شکل 8). پاتوژن های ریشه (اعم از باکتری ها و قارچ ها) می توانند سطح جذبی خاک را از بین ببرند و به همین ترتیب پاتوژن های برگی نیز می توانند سطوح تبخیری برگ ها را از بین ببرند، عملکرد روزنه ها را تغییر دهند یا یکپارچگی کوتیکول را مختل کنند. سایر ارگانیسم ها (به عنوان مثال حشرات و نماتدها) می توانند باعث اختلال مشابه در قسمت های بالای و زیر زمینی گیاهان درگیر در انتقال آب شوند.
عوامل بیوتیک مسئول توقف جریان در لوله های آوند چوبی عبارتند از: ارگانیسم های بیماری زا و محصولات جانبی آنها که مجراها را مسدود می کنند (شکل 8). ژل ها و صمغ های گیاهی که در پاسخ به تهاجم پاتوژن تولید می شوند. و تایلوزها، که خروجی هایی هستند که توسط سلول های گیاهی زنده که یک رگ را احاطه کرده اند تولید می شوند تا پس از زخم یا حمله پاتوژن، آن را ببندند (شکل 8).
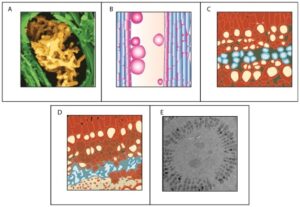
شکل 8: منابع اختلال عملکرد در آوند چوبی.
از چپ به راست: (الف) پاتوژن های ساکن آوند چوبی مانند باکتری Xylella fastidiosa. (ب) تایلوزها (مشتق شده از گیاه)؛ (C و D) مجرای (به رنگ آبی) انفجار (Brodribb and Holbrook 2005, Pine needle tracheids); و (E) مجراهای آمبولیزه شده در میان لوله های پر از آب در نمونه های گیاهی منجمد (شکل منتشر نشده).
عوامل غیرزیستی می توانند به همان اندازه جریان را در نقاط مختلف مسیر انتقال آب مختل کنند. در طول خشکسالی، ریشهها منقبض میشوند و تماس خود را با آب چسبیده به ذرات خاک از دست میدهند – فرآیندی که میتواند با محدود کردن اتلاف آب توسط ریشهها به خاکهای خشکشده نیز مفید باشد (یعنی آب میتواند به صورت معکوس جریان یابد و از ریشهها خارج شود که با خشک کردن خاک بیرون میکشد). . تحت کم آبی شدید گیاه، برخی از مجراهای سوزنی کاج در واقع می توانند با افزایش کشش آوند چوبی فرو بریزند (شکل 8).
آب در حال حرکت از طریق گیاهان متاپایدار در نظر گرفته می شود زیرا در یک نقطه خاص با افزایش تنش ستون آب می شکنند . پدیده ای که به آن کاویتاسیون گفته می شود. پس از ایجاد کاویتاسیون، یک حباب گاز (به عنوان مثال آمبولی) می تواند تشکیل شود و مجرا را پر کند و به طور موثر حرکت آب را مسدود کند. هم دماهای زیر صفر و هم خشکسالی می توانند باعث آمبولی شوند. یخ زدگی می تواند باعث آمبولی شوند، زیرا وقتی آب مایع به یخ تبدیل می شود، هوا از محلول خارج می شود. خشکی همچنین باعث آمبولی می شود زیرا با خشک شدن گیاهان تنش در ستون آب افزایش می یابد. یک نقطه بحرانی وجود دارد که در آن کشش از فشار لازم برای کشیدن هوا از یک مجرای خالی به یک مجرای پر شده در سراسر یک غشای گودال فراتر می رود . این آسپیراسیون به عنوان بارور کردن هوا
شناخته می شود (شکل 9). یک دانه هوا یک فضای خالی در آب ایجاد می کند و کشش باعث گسترش فضای خالی و شکستن ستون پیوسته می شود. آستانه کاشت هوا با حداکثر قطر منافذ موجود درغشاهای گودال یک مجرای معین تنظیم می شود.نشان می دهد که چگونه افزایش کشش در یک ظرف پر از آب کاربردی در نهایت به آستانه ای می رسد که در آن یک دانه هوا از یک مجرای آمبولیزه شده در سراسر غشای گودال کشیده می شود. هوا فقط پس از رسیدن به آستانه فشار وارد مجرای عملکردی می شود. شکل 9: مکانیسم کاشت هوا.
رفع مشکل
عدم برقراری مجدد جریان در مجراهای آمبولیزه ظرفیت هیدرولیکی را کاهش می دهند، فتوسنتز را محدود می کنند و در موارد شدید منجر به مرگ گیاه می شود. گیاهان می توانند با هدایت آب به اطراف انسدادها از طریق چاله هایی که مجراهای عملکردی مجاور را به هم متصل می کنند و با رشد آوند چوبی جدید برای جایگزینی ظرفیت هیدرولیکی از دست رفته، با آمبولی مقابله کنند. برخی از گیاهان توانایی تعمیر شکستگیهای ستونهای آب را دارند، اما جزئیات این فرآیند درآوند چوبی تحت کشش برای دههها نامشخص باقی مانده است. برودرسن و همکاران (2010) اخیراً فرآیند پر کردن مجدد در انگورهای زنده (Vitis vinifera L.) را با استفاده از توموگرافی کامپیوتری اشعه ایکس با وضوح بالا (نوعی اسکن CAT) تجسم و کمی سازی کرد (شکل 10). پر کردن مجدد ظروف موفقیت آمیز به هجوم آب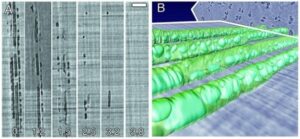
از سلول های زنده اطراف کانال های آوند چوبی بستگی داشت، جایی که قطرات آب منفرد در طول زمان منبسط می شدند، ظروف را پر می کردند و گاز محبوس شده را مجبور به حل شدن می کردند. ظرفیت کارخانه های مختلف برای تعمیر آوندهای آوند چوبی آسیب دیده و مکانیسم های کنترل این تعمیرات در حال حاضر در حال بررسی است.
شکل 10: ترمیم آمبولی مستند شده در انگور (Vitis vinifera L.) با میکرو CT اشعه ایکس در مرکز ALS در آزمایشگاه ملی لارنس برکلی، کالیفرنیا، ایالات متحده.
(الف) بخش طولی که یک سری زمانی از رگهای حفرهدار را نشان میدهند که در کمتر از 4 ساعت دوباره پر میشوند. (ب) بازسازی سه بعدی چهار لومن رگ با قطرات آب که بر روی دیواره رگ تشکیل شده و در طول زمان رشد می کنند تا مجرای آمبولی شده را کاملا پر کنند.
References and Recommended Reading
Agrios, G. N. Plant Pathology. New York, NY: Academic Press, 1997.
Beerling, D. J. & Franks, P. J. Plant science: The hidden cost of transpiration. Nature 464, 495-496 (2010).
Brodersen, C. R. et al. The dynamics of embolism repair in xylem: In vivo visualizations using high-resolution computed tomography Plant Physiology 154, 1088-1095 (2010).
Brodribb, T. J. & Holbrook, N. M. Water stress deforms tracheids peripheral to the leaf vein of a tropical conifer. Plant Physiology 137, 1139-1146 (2005)
Canadell, J. et al. Maximum rooting depth of vegetation types at the global scale. Oecologia 108, 583-595 (1996).
Choat, B., Cobb, A. R. & Jansen, S. Structure and function of bordered pits: New discoveries and impacts on whole-plant hydraulic function. New Phytologist 177, 608-626 (2008).
Chung, H. H. & Kramer, P. J. Absorption of water and “P through suberized and unsuberized roots of loblolly pine. Canadian Journal of Forest Research 5, 229-235 (1975).
Eapen, D. et al. Hydrotropism: Root growth responses to water. Trends in Plant Science 10, 44-50 (2005).
Hetherington, A. M. & Woodward, F. I. The role of stomata in sensing and driving environmental change. Nature 424, 901-908 (2003).
Holbrook, N. M. & Zwieniecki, M. A. Vascular Transport in Plants. San Diego, CA: Elsevier Academic Press, 2005.
Javot, H. & Maurel, C. The role of aquaporins in root water uptake. Annals of Botany 90, 1-13 (2002).
Kramer, P. J. & Boyer, J. S. Water Relations of Plants and Soils. New York, NY: Academic Press, 1995.
Kramer, P. J. & Bullock, H. C. Seasonal variations in the proportions of suberized and unsuberized roots of trees in relation to the absorption of water. American Journal of Botany 53, 200-204 (1966).
MacFall, J. S., Johnson, G. A. & Kramer, P. J. Observation of a water-depletion region surrounding loblolly pine roots by magnetic resonance imaging. Proceedings of the National Academy of Sciences of the United States of America 87, 1203-1207 (1990).
McCully, M. E. Roots in Soil: Unearthing the complexities of roots and their rhizospheres. Annual Review of Plant Physiology and Plant Molecular Biology 50, 695-718 (1999).
McDowell, N. G. et al. Mechanisms of plant survival and mortality during drought: Why do some plants survive while others succumb to drought? New Phytologist 178, 719-739 (2008).
Nardini, A., Lo Gullo, M. A. & Salleo, S. Refilling embolized xylem conduits: Is it a matter of phloem unloading? Plant Science 180, 604-611 (2011).
Pittermann, J. et al. Torus-margo pits help conifers compete with angiosperms. Science 310, 1924 (2005).
Sack, L. & Holbrook, N. M. Leaf hydraulics. Annual Review of Plant Biology 57, 361-381 (2006).
Sack, L. & Tyree, M. T. “Leaf hydraulics and its implications in plant structure and function,” in Vascular Transport in Plants, eds. N. M. Holbrook & M. A. Zwieniecki. (San Diego, CA: Elsevier Academic Press, 2005) 93-114.
Schenk, H. J. & Jackson, R. B. Rooting depths, lateral root spreads, and belowground/aboveground allometries of plants in water-limited environments. Journal of Ecology 90, 480-494 (2002).
Sperry, J. S. & Tyree, M. T. Mechanism of water-stress induced xylem embolism. Plant Physiology 88, 581-587 (1988).
Steudle, E. The cohesion-tension mechanism and the acquisition of water by plants roots. Annual Review of Plant Physiological and Molecular Biology 52, 847-875 (2001).
Steudle, E. Transport of water in plants. Environmental Control in Biology 40, 29-37 (2002).
Takahashi, H. Hydrotropism and its interaction with gravitropism in roots. Plant Soil 165, 301-308 (1994).
Tyree, M. T. & Ewers, F. W. The hydraulic architecture of trees and other woody plants. New Phytologist 119, 345-360 (1991).
Tyree, M. T. & Sperry, J. S. Vulnerability of xylem to cavitation and embolism. Annual Review of Plant Physiology and Molecular Biology 40, 19-38 (1989).
Tyree, M. T. & Zimmerman, M. H. Xylem Structure and the Ascent of Sap. 2nd ed. New York, NY: Springer-Verlag, 2002.
Tyree, M. T. & Ewers, F. The hydraulic architecture of trees and other woody plants. New Phytologist 119, 345-360 (1991).
Wheeler, T. D. & Stroock, A. D. The transpiration of water at negative pressures in a synthetic tree. Nature 455, 208-212 (2008).
Wullschleger, S. D., Meinzer, F. C. & Vertessy, R. A. A review of whole-plant water use studies in trees. Tree Physiology 18, 499-512 (1998).
Zimmerman, M. H. Xylem Structure and the Ascent of Sap. 1st ed. Berlin, Germany: Springer-Verlag, 1983.
Outline | Keywords FeedBack
